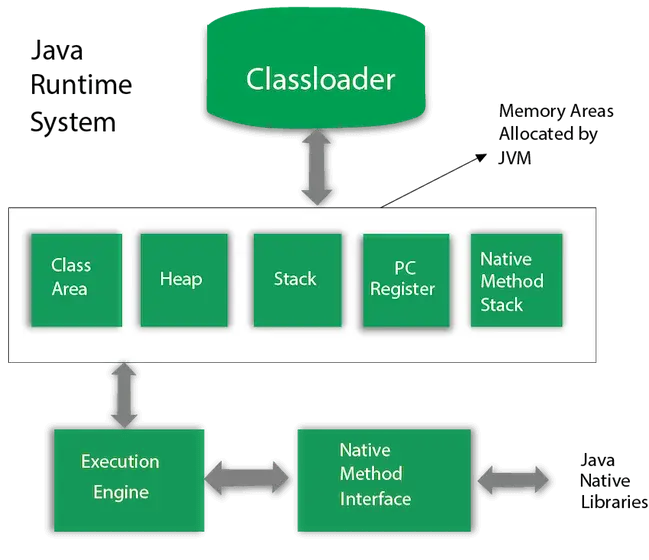
Hibridizacija NO2

Hibridizacija NO 2 je sp 2 . Pri hibridizaciji NO nastanejo tri enakovredne hibridne orbitale 2 . Dušikov dioksid ali NO 2 sestoji iz dveh atomov kisika v kombinaciji z enim atomom dušika. Hibridizacija NO 2 je koristno preučiti razporeditev atomskih orbital in njen vpliv na molekularno strukturo in značilnosti.
V tem članku bomo raziskali idejo hibridizacije in zagotovili jasno in razumljivo razlago hibridizacije NO 2 skupaj s hibridizacijo obeh njegovih ionov NO 2 + in NE 2 – .
Kazalo
- Dušikov dioksid [NO2]
- Kaj je hibridizacija dušikovega dioksida (NO2)?
- Hibridizacija NO2+ in NO2-
- Hibridizacija NO2: pogosta vprašanja
Kaj je hibridizacija?
Hibridizacija je v kemiji postopek združevanja atomskih orbital, da se ustvarijo nove hibridne orbitale, ki vplivajo na molekularno geometrijo spojine in lastnosti vezi.
Različne vrste hibridizacije so:
- sp Hibridizacija
- sp 2 Hibridizacija
- sp 3 Hibridizacija
Preberi več, Hibridizacija .
Kaj je hibridizacija dušikovega dioksida (NO 2 )?
Hibridizacija NO 2 je sp 2 .
Pri tej hibridizaciji nastanejo tri enakovredne hibridne orbitale. Tukaj je dušik osrednji atom, vezan z dvema atomoma kisika. Dušik ima 5 valenčnih elektronov, razporejenih v 2s 2 2p. En elektron 2s orbitale in dva elektrona 2p orbitale so sodelovali pri hibridizaciji NO 2 tako nastanejo skupaj tri hibridne orbitale (1 + 2 = 3), kar daje sp 2 hibridizacija NO 2 .
Sigma vezi nastanejo, ko se te hibridne orbitale prekrivajo s kisikovimi orbitalami in p orbitala dušikovega atoma tvori pi vez z atomom kisika.

Dušikov dioksid [NO 2 ]
Dušikov dioksid nastane, ko se dva atoma kisika in en atom dušika združita in tvorita dvoatomsko molekulo NO 2 . Je rdečkasto rjav plin, ki ima izrazit videz in oster, pekoč vonj. Pri sobni temperaturi je to plin, ki ima upognjeno ali V-obliko molekularne geometrije.
Poleg tega NE 2 je pomembna tema raziskav v kemijskem in okoljskem kontekstu, ker vpliva na onesnaženje zraka in atmosfersko kemijo.
Lastnosti NO 2
Pomembne značilnosti NO 2 so navedeni spodaj:
| Lastnina | Opis |
|---|---|
| Kemijska formula | št 2 |
| Molekularna struktura | Ukrivljen ali v obliki črke V |
| Stanje pri sobni temperaturi | Plin |
| barva | Rdečkasto rjava |
| Neprijeten vonj | Oster, grizeč |
| Tališče | −11,2 °C |
| Vrelišče | 21,2 °C |
Lewisova struktura NO 2
Podroben opis Lewisove strukture NO 2 molekula je podana spodaj:
- Dušik tvori dvojno vez z enim kisikom in petimi valenčnimi elektroni, pri čemer si oba elementa delita dva elektrona.
- En elektron prispeva drugi kisik, saj tvori enojno vez.
- En samski par zadrži atom dušika.
- Z dušikom kot osrednjim atomom in negativnim nabojem (NO 2 – ) na celotni molekuli ta konfiguracija povzroči linearno strukturo.

Preberi več,
- Dušikov dioksid
- Dušikovi oksidi
Vezni kot in geometrija pri hibridizaciji NO 2
Molekularna geometrija NO 2 postane upognjen ali v obliki črke V zaradi hibridizacije. Atom dušika je podvržen sp 2 hibridizacijo, ki povzroči to konfiguracijo. Atomi dušika in kisika tvorijo vezni kot, ki je približno 134 stopinj . Posledica razporeditve hibridnih orbital je ta popačen vezni kot, ki prispeva k dušikovemu dioksidu (NO 2 ) razločno strukturo in značilnosti.
Hibridizacija NO 2 + in NE 2 –
Hibridizacija je NE 2 + in NE 2 – obravnavano spodaj:
Hibridizacija dušikovih ionov [NO 2 + ]
Hibridizacija NO 2 + kot sledi:
- Pozitivni naboj je prisoten v dušikovem ionu (NO 2 + ).
- V ŠT 2 + , dva atoma kisika in en atom dušika sta povezana skupaj.
- Za ustvarjanje dveh sp hibridnih orbital gre atom dušika skozi sp hibridizacijo.
- Za tvorbo dveh sigma vezi se te sp hibridne orbitale prekrivajo s p orbitalami kisika.
- Geometrija molekule je linearna.
- Sledi predstavitev hibridizacije: N(sp) + O(p) + O(p).
Hibridizacija ionskega nitrata [ŠT 2 – ]
Hibridizacija NO 2 – kot sledi:
- Negativni naboj je prisoten v nitritnih ionih (NO 2 – ).
- V ŠT 2 – , dva atoma kisika in en atom dušika sta povezana skupaj.
- Za ustvarjanje treh sp 2 hibridne orbitale gre atom dušika skozi sp 2 hibridizacija.
- Za tvorbo treh sigma vezi so ti sp 2 hibridne orbitale se prekrivajo s p orbitalami kisika.
- Geometrija molekule je trigonalno planarna.
- Naslednje predstavlja hibridizacijo: N(sp 2 ) + O(p) + O(p).
Zaključek
Za zaključek še več o NO 2 Hibridizacija ponuja pomembne nove poglede na sestavo in značilnosti molekule. Na splošno geometrijo vpliva dušik sp 2 hibridizacijo, ki daje upognjeno molekulo ali molekulo v obliki črke V z veznim kotom približno 134 stopinj. Edinstvene lastnosti NO 2 so delno pripisane neenakim dolžinam vezi v N-O vezeh.
| Vidik | Opis |
|---|---|
| Hibridizacija | št 2 prestane sp 2 hibridizacija |
| Molekularna geometrija | Ukrivljen ali v obliki črke V |
| Vezni kot | Približno 134 stopinj med dušikom in kisikom |
| Popačenje dolžine vezi | Neenake dolžine vezi zaradi sp 2 hibridizacija |
Preverite tudi, Hibridizacija SF 4
Hibridizacija NO 2 : pogosta vprašanja
1. Kako deluje NO 2 Vplivajo na okolje?
Eden glavnih onesnaževalcev zraka je NO 2 , ki vpliva tako na ekosistem kot na zdravje ljudi, saj povzroča težave z dihali in kisli dež.
2. Kateri vezni kot je večji med NO 2 + ali ne 2 ?
Medtem ko NE 2 ima manjši vezni kot s sp2 hibridizacijo in trigonalno planarno strukturo, NO2+ ima širši vezni kot, ko prehaja preko sp hibridizacije z linearno geometrijo.
3. Kakšna je geometrija NO 2 ?
Struktura NO 2 molekula je upognjena ali v obliki črke V.
4. Kakšna je molekularna geometrija NO 2 + ?
Geometrija NO 2 + molekule so linearne.
5. Koliko sigma in pi vezi je v NO₂?
NO₂ ima eno sigma vez in eno pi vez.
6. Ali je NO₂ polaren ali nepolaren?
NO₂ je polarni delec zaradi prisotnosti osamljenega para na dušiku in ukrivljenega subatomskega izračuna, ki spodbuja enostransko kroženje naboja.
7. Kakšen je vezni kot v NO₂?
Vezni kot v NO 2 je približno 134 stopinj.