Hybrydyzacja
Koncepcja hybrydyzacja definiuje się jako proces łączenia dwóch orbitali atomowych w celu utworzenia nowego typu orbitali zhybrydyzowanych. To mieszanie zazwyczaj skutkuje utworzeniem orbitali hybrydowych o zupełnie różnych energiach, kształtach i tak dalej. Hybrydyzację przeprowadza się głównie za pomocą orbitali atomowych o tym samym poziomie energii. Jednak zarówno w pełni zapełnione, jak i w połowie zapełnione orbitale mogą brać udział w tym procesie, jeśli ich energie są równe. Koncepcja hybrydyzacji jest rozszerzeniem teorii wiązań walencyjnych, która pomaga nam zrozumieć powstawanie wiązań, energie wiązań i długości wiązań.
Co to jest hybrydyzacja?
Kiedy dwa orbitale atomowe łączą się, tworząc orbital hybrydowy w cząsteczce, energia orbitali poszczególnych atomów jest redystrybuowana, tworząc orbitale o równoważnej energii. Nazywa się to hybrydyzacją.
Orbitale atomowe o porównywalnych energiach są mieszane ze sobą podczas procesu hybrydyzacji, który najczęściej polega na połączeniu dwóch orbitali lub dwóch orbitali „p” lub zmieszaniu orbitalu „s” z orbitalem „p” oraz „s” orbital z orbitalem „d”.
Orbitale hybrydowe to nowe orbitale powstałe w wyniku tego procesu. Co ważniejsze, orbitale hybrydowe można wykorzystać do wyjaśnienia właściwości wiązań atomowych i geometrii molekularnej. Na przykład węgiel tworzy cztery pojedyncze wiązania, w których orbital s powłoki walencyjnej łączy się z trzema orbitalami p powłoki walencyjnej. Ta kombinacja generuje cztery równoważne sp 3 mieszaniny. Zostaną one ułożone w czworościenny wzór wokół węgla, który jest związany z czterema różnymi atomami.
Etapy określania rodzaju hybrydyzacji
Aby zrozumieć rodzaj hybrydyzacji w atomie lub jonie, należy przestrzegać następujących zasad.
- Najpierw określ całkowitą liczbę elektronów walencyjnych zawartych w atomie lub jonie.
- Następnie policz liczbę samotnych par przyłączonych do tego atomu lub jonu.
- Teraz liczbę wymaganych orbitali można obliczyć, dodając liczbę dupleksów lub oktetów i liczbę wolnych par elektronów.
- Należy zauważyć, że geometria orbitali w atomach lub jonach jest inna, gdy nie ma samotnej pary elektronów.
Cechy hybrydyzacji
- Hybrydyzacja zachodzi pomiędzy orbitalami atomowymi o równych energiach.
- Liczba utworzonych orbitali hybrydowych jest równa liczbie mieszających się orbitali atomowych.
- Nie jest wymagane, aby wszystkie orbitale w połowie wypełnione brały udział w hybrydyzacji. Mogą w nich uczestniczyć nawet orbitale całkowicie wypełnione, ale o nieco zróżnicowanej energii.
- Hybrydyzacja zachodzi tylko podczas tworzenia wiązania, a nie w pojedynczym atomie gazowym.
- Jeśli znana jest hybrydyzacja cząsteczki, można przewidzieć jej kształt.
- Większy płat orbitalu hybrydowego jest zawsze dodatni, podczas gdy mniejszy płat po przeciwnej stronie jest zawsze ujemny.
Typy hybrydyzacji
Hybrydyzację można sklasyfikować jako sp 3 , sp 2 , sp., sp 3 d, sp 3 D 2 lub sp 3 D 3 w oparciu o rodzaje orbitali biorących udział w mieszaniu.
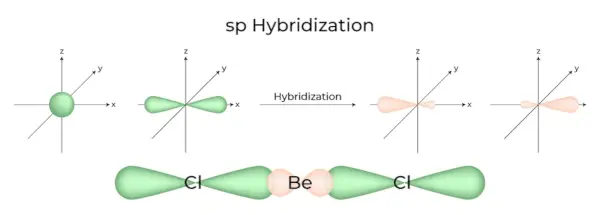
sp Hybrydyzacja
Dzieje się tak, gdy jeden orbital s i jeden p w głównej powłoce atomu łączą się, tworząc dwa nowe równoważne orbitale. Nowo utworzone orbitale są znane jako orbitale zhybrydyzowane sp. Wytwarza cząsteczki liniowe pod kątem 180°. Polega to na połączeniu własnego orbitalu i jednego orbitalu „p” o równej energii w celu wytworzenia nowego orbitalu hybrydowego, znanego jako orbital zhybrydyzowany sp.
- Nazywa się to również hybrydyzacją diagonalną.
- Każdy zhybrydyzowany orbital sp zawiera taką samą liczbę znaków s i p.
- Wszystkie związki berylu, takie jak BeF 2 , Dobrze 2 i BeCl 2 , to przykłady.

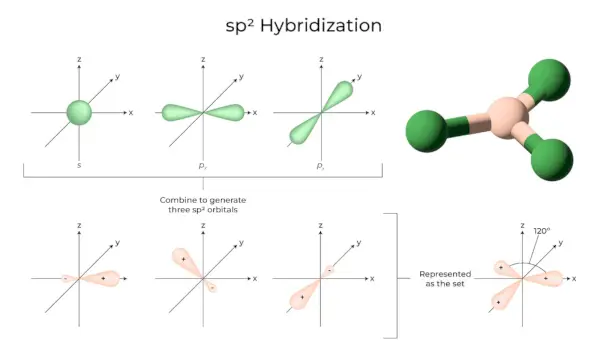
sp 2 Hybrydyzacja
Dzieje się tak, gdy jeden orbital s i dwa p powłoki tego samego atomu łączą się, tworząc trzy równoważne orbitale. Nowo utworzone orbitale są znane jako sp 2 orbitale hybrydowe. Nazywa się ją również hybrydyzacją trygonalną. Polega na połączeniu własnego orbitalu z dwoma orbitalami „p” o równej energii w celu stworzenia nowego orbitalu hybrydowego znanego jako sp 2 . Mieszanina symetrii trygonalnej orbitali s i p jest utrzymywana w temperaturze 120 stopni. Wszystkie trzy orbitale hybrydowe pozostają w tej samej płaszczyźnie i tworzą ze sobą kąt 120°.
- Każdy utworzony orbital hybrydowy ma 33,33% i 66,66% znaku „p”.
- Cząsteczki o trójkątnym, płaskim kształcie mają centralny atom, który jest połączony z trzema innymi atomami i ma sp 2 hybrydyzowane. Przykładami są związki boru.
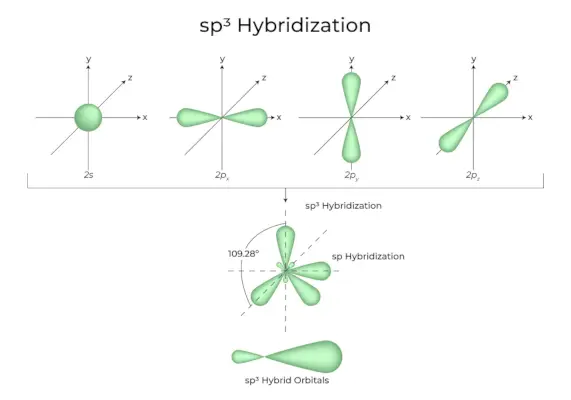
sp 3 Hybrydyzacja
Kiedy jeden orbital „s” i trzy orbitale „p” z tej samej powłoki atomu łączą się, tworząc cztery nowe równoważne orbitale, hybrydyzacja jest znana jako hybrydyzacja tetraedryczna lub sp 3 . Nowo utworzone orbitale są znane jako sp 3 orbitale hybrydowe. Są one skierowane w cztery rogi czworościanu foremnego i tworzą między sobą kąt 109°28′.
- Sp 3 Orbitale hybrydowe tworzą kąt 109,28 stopnia.
- Każdy orbital hybrydowy ma 25% charakteru s i 75% charakteru p.
- Etan i metan to dwa przykłady.
sp 3 d Hybrydyzacja
Mieszanie orbitali 1s, orbitali 3p i orbitali 1d daje w wyniku 5 zhybrydyzowanych orbitali sp3d o równej energii. Ich geometria jest dwupiramidalna trygonalna. Połączenie orbitali s, p i d skutkuje trygonalną symetrią bipiramidalną. Orbitale równikowe to trzy orbitale hybrydowe, zorientowane względem siebie pod kątem 120° i leżące w płaszczyźnie poziomej.
- Pozostałe dwa orbitale, zwane orbitalami osiowymi, znajdują się w płaszczyźnie pionowej pod kątem 90 stopni do orbitali równikowych.
- Na przykład hybrydyzacja w pięciochlorku fosforu (PCl 5 ).
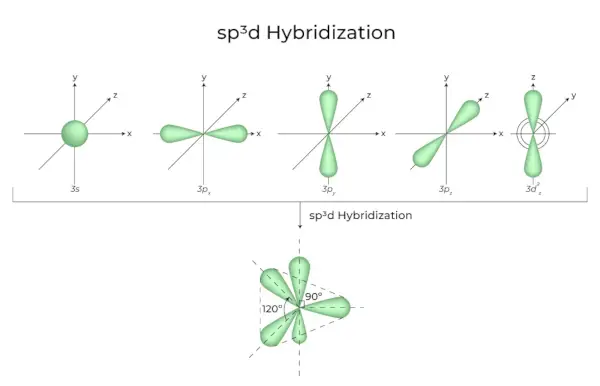
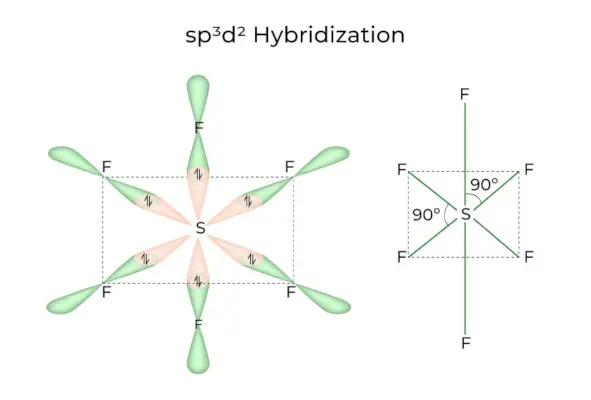
sp 3 D 2 Hybrydyzacja
Kiedy orbitale 1s, 3p i 2d łączą się, tworząc 6 identycznych sp 3 D 2 orbitale hybrydowe, hybrydyzacja nazywana jest sp 3 D 2 Hybrydyzacja. Te siedem orbitali wskazuje narożniki ośmiościanu. Są one nachylone względem siebie pod kątem 90 stopni.
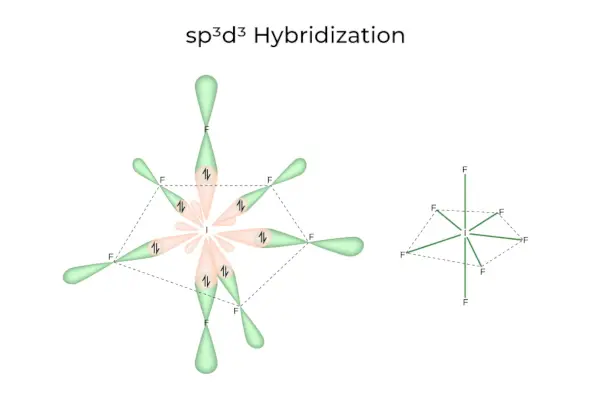
sp 3 D 3 Hybrydyzacja
Posiada orbitale 1s, 3p i 3d, które łączą się, tworząc 7 identycznych sp 3 D 3 orbitale hybrydowe. Te siedem orbitali wskazuje na narożniki pięciokątnej bipiramidy. np. JEŚLI 6 .
Kształty hybrydyzacji
- Liniowy: hybrydyzacja sp jest spowodowana oddziaływaniem grup dwuelektronowych; kąt orbity wynosi 180°. Planarny trygonalny: zaangażowane są trzy grupy elektronów, w wyniku czego powstaje sp 2 hybrydyzacja; orbitale są od siebie oddalone o 120°. Tetraedryczny: zaangażowane są cztery grupy elektronowe, w wyniku czego powstaje sp 3 hybrydyzacja; kąt orbity wynosi 109,5 °. Dwupiramid trygonalny: zaangażowanych jest pięć grup elektronowych, w wyniku czego powstaje sp 3 d hybrydyzacja; kąty orbity wynoszą 90° i 120°. Oktaedryczny: zaangażowanych jest sześć grup elektronowych, w wyniku czego powstaje sp 3 D 2 hybrydyzacja; orbitale są od siebie oddalone o 90°.
Często zadawane pytania na Hybrydyzacja
Pytanie 1: Który orbital hybrydowy, spośród sp, sp2 i sp3, jest bardziej elektroujemny?
Odpowiedź:
Procent znaku s w sp, sp 2 i sp 3 węgiel zhybrydyzowany wynosi odpowiednio 50%, 33,33% i 25%. Ze względu na kulisty kształt orbitalu s, jest on przyciągany równomiernie ze wszystkich kierunków przez jądro. W rezultacie orbital hybrydowy ze znakiem s będzie bliżej jądra, a zatem będzie bardziej elektroujemny. W rezultacie węgiel zhybrydyzowany sp jest najbardziej elektroujemny.
Pytanie 2: Czym są orbitale hybrydowe?
Odpowiedź:
Orbitale hybrydowe powstają w wyniku połączenia standardowych orbitali atomowych i powstania nowych orbitali atomowych.
Pytanie 3: Jakich jest pięć kształtów hybrydyzacji?
Odpowiedź:
Liniowy, trygonalny planarny, czworościenny, trygonalny bipiramidalny i oktaedryczny to pięć podstawowych kształtów hybrydyzacji.
Pytanie 4: Dlaczego cząsteczka amidu wygląda jak sp 3 hybrydyzowany, ale jest sp 2 ?
Odpowiedź:
Jeśli atom jest otoczony przez dwa lub więcej orbitali p lub ma samotną parę zdolną do wskoczenia na orbital p, ogólny proces hybrydyzacji ulegnie zmianie. W rezultacie w przypadku cząsteczki amidu samotna para wchodzi na orbital p, w wyniku czego powstają trzy sąsiednie równoległe orbitale p.
Pytanie 5: Jaka jest reguła Benta?
Odpowiedź:
Centralny atom połączony z wieloma grupami w cząsteczce będzie hybrydyzował, powodując, że orbitale o bardziej charakterze s będą skierowane w stronę grup elektrododatnich, a orbitale o większym charakterze p będą skierowane w stronę grup elektroujemnych.