Hybridisering

Konseptet av hybridisering er definert som prosessen med å kombinere to atomorbitaler for å skape en ny type hybridiserte orbitaler. Denne sammenblandingen resulterer typisk i dannelsen av hybridorbitaler med helt forskjellige energier, former og så videre. Hybridisering utføres først og fremst av atomorbitaler med samme energinivå. Imidlertid kan både helt fylte og halvfylte orbitaler delta i denne prosessen hvis energien deres er like. Konseptet hybridisering er en utvidelse av valensbindingsteori som hjelper oss å forstå bindingsdannelse, bindingsenergier og bindingslengder.
Hva er hybridisering?
Når to atomorbitaler kombineres for å danne en hybrid orbitaler i et molekyl, blir energien til orbitalene til individuelle atomer omfordelt for å gi orbitaler med ekvivalent energi. Dette er kjent som hybridisering.
Atomorbitalene til sammenlignbare energier blandes sammen under hybridiseringsprosessen, som for det meste involverer sammenslåing av to orbitaler eller to 'p'-orbitaler eller blanding av en 's'-orbital med en 'p'-orbital så vel som en 's' orbital med en 'd' orbital.
Hybride orbitaler er de nye orbitalene dannet som et resultat av denne prosessen. Enda viktigere, hybridorbitaler kan brukes til å forklare atombindingsegenskaper og molekylær geometri. Karbon, for eksempel, danner fire enkeltbindinger der valens-skallets orbitaler kombineres med tre valens-skall p-orbitaler. Denne kombinasjonen genererer fire ekvivalente sp 3 blandinger. Disse vil være ordnet i et tetraedrisk mønster rundt karbonet, som er bundet til fire forskjellige atomer.
Trinn for å bestemme typen hybridisering
For å forstå typen hybridisering i et atom eller et ion, må følgende regler følges.
- Bestem først det totale antallet valenselektroner som finnes i et atom eller ion.
- Tell deretter antall ensomme par knyttet til det atomet eller ionet.
- Nå kan antallet orbitaler som kreves beregnes ved å legge til antall dupleks eller oktett og antall ensomme elektronpar.
- Det skal bemerkes at geometrien til orbitaler i atomer eller ioner er forskjellig når det ikke er et enkelt elektronpar.
Funksjoner ved hybridisering
- Hybridisering skjer mellom atomorbitaler med like energier.
- Antall hybridorbitaler som dannes tilsvarer antallet atomorbitaler som blandes.
- Det er ikke nødvendig for alle halvfylte orbitaler å delta i hybridisering. Selv orbitaler som er helt fylte, men som har litt varierende energi kan delta.
- Hybridisering skjer bare under bindingsdannelse, ikke i et enkelt gassformet atom.
- Hvis hybridiseringen av molekylet er kjent, kan molekylets form forutsies.
- Den større lappen til hybridorbitalen er alltid positiv, mens den mindre lappen på motsatt side alltid er negativ.
Typer av hybridisering
Hybridisering kan klassifiseres som sp 3 , sp 2 , sp, sp 3 d, sp 3 d 2 , eller sp 3 d 3 basert på typene orbitaler som er involvert i blanding.
sp Hybridisering
Det oppstår når en s og en p-orbital i et atoms hovedskall kombineres for å danne to nye ekvivalente orbitaler. De nydannede orbitalene er kjent som sp-hybridiserte orbitaler. Den produserer lineære molekyler i en vinkel på 180°. Det innebærer å kombinere ens orbital og en 'p' orbital med lik energi for å produsere en ny hybrid orbital kjent som en sp hybridisert orbital.
- Det er også kjent som diagonal hybridisering.
- Hver sp-hybridisert orbital inneholder samme mengde s- og p-tegn.
- Alle berylliumforbindelser, som BeF 2 , Vi vil 2 og BeCl 2 , er eksempler.

sp 2 Hybridisering
Det oppstår når en s og to p-orbitaler av samme atoms skall kombineres for å danne tre ekvivalente orbitaler. De nydannede orbitalene er kjent som sp 2 hybrid orbitaler. Det er også kjent som trigonal hybridisering. Det innebærer å kombinere ens orbital med to 'p' orbitaler med lik energi for å lage en ny hybrid orbital kjent som sp 2 . En trigonal symmetriblanding av s- og p-orbitaler holdes ved 120 grader. Alle de tre hybridorbitalene forblir i samme plan og danner en 120° vinkel med hverandre.
- Hver hybrid orbital som dannes har en 33,33 % og en 66,66 % 'p' karakter.
- Molekylene med en trekantet plan form har et sentralt atom som er knyttet til tre andre atomer og er sp. 2 hybridisert. Borforbindelser er eksempler.
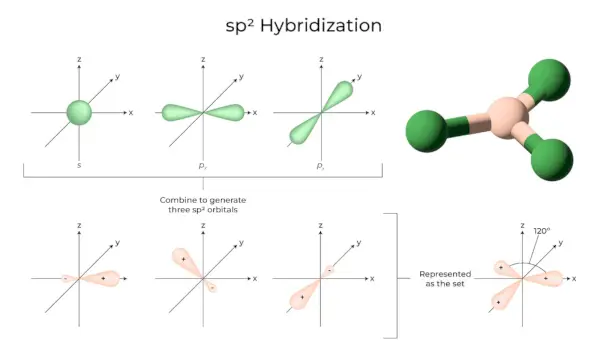
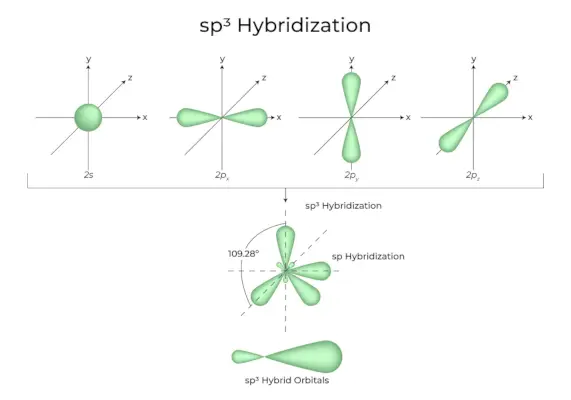
sp 3 Hybridisering
Når en 's' orbitaler og tre 'p' orbitaler fra samme skall av et atom kombineres for å danne fire nye ekvivalente orbitaler, er hybridiseringen kjent som tetraedrisk hybridisering eller sp 3 . De nydannede orbitalene er kjent som sp 3 hybrid orbitaler. Disse peker på de fire hjørnene av et vanlig tetraeder og danner en 109°28′ vinkel med hverandre.
- Sp 3 hybridorbitaler danner en vinkel på 109,28 grader.
- Hver hybridorbital har et 25 % s-karakter og et 75 % p-karakter.
- Etan og metan er to eksempler.
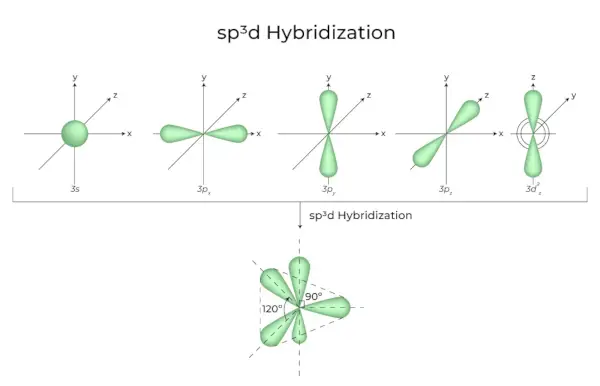
sp 3 d Hybridisering
Blandingen av 1s orbitaler, 3p orbitaler og 1d orbitaler resulterer i 5 sp3d hybridiserte orbitaler med lik energi. Geometrien deres er trigonal bipyramidal. Kombinasjonen av s, p og d orbitaler resulterer i trigonal bipyramidal symmetri. Ekvatorialorbitalene er tre hybridorbitaler som er orientert i 120° vinkel til hverandre og ligger i horisontalplanet.
- De resterende to orbitalene, kjent som aksiale orbitaler, er i vertikalplanet i 90 graders plan av ekvatorialorbitalene.
- Hybridisering i fosforpentaklorid, for eksempel (PCl 5 ).
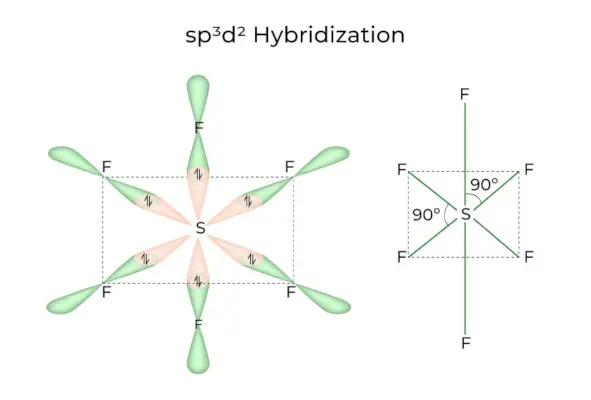
sp 3 d 2 Hybridisering
Når 1s, 3p og 2d orbitaler kombineres for å danne 6 identiske sp 3 d 2 hybridorbitaler, hybridiseringen kalles sp 3 d 2 Hybridisering. Disse syv orbitalene peker mot hjørnene av et oktaeder. De er skråstilt i en 90-graders vinkel til hverandre.
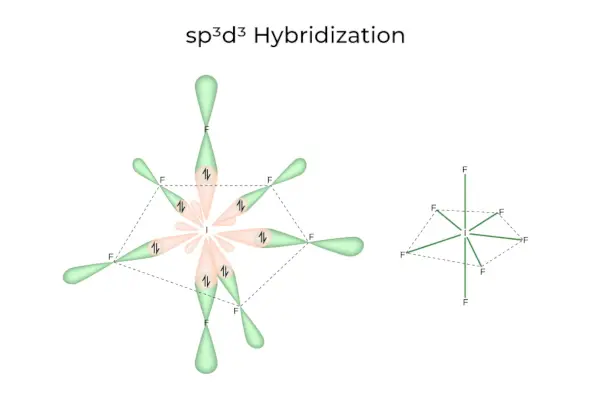
sp 3 d 3 Hybridisering
Den har 1s, 3p og 3d orbitaler, som kombineres for å danne 7 identiske sp 3 d 3 hybrid orbitaler. Disse syv orbitalene peker mot hjørnene av en femkantet bipyramidal. f.eks. HVIS 6 .
Former for hybridisering
- Lineær: sp-hybridiseringen er forårsaket av interaksjonen mellom to-elektrongrupper; banevinkelen er 180°. Trigonal planar: Tre elektrongrupper er involvert, noe som resulterer i sp 2 hybridisering; orbitalene er 120° fra hverandre. Tetraedrisk: Fire elektrongrupper er involvert, noe som resulterer i sp 3 hybridisering; banevinkelen er 109,5°. Trigonal bipyramidal: Fem elektrongrupper er involvert, noe som resulterer i sp 3 d hybridisering; banevinklene er 90° og 120°. Octahedral: Seks elektrongrupper er involvert, noe som resulterer i sp 3 d 2 hybridisering; orbitalene er 90° fra hverandre.
Vanlige spørsmål på Hybridisering
Spørsmål 1: Blant sp, sp2 og sp3, hvilken hybrid orbital er mer elektronegativ?
Svar:
Prosentandelen av s-tegn i sp, sp 2 og sp 3 hybridisert karbon er henholdsvis 50 %, 33,33 % og 25 %. På grunn av den sfæriske formen til s orbital, tiltrekkes den jevnt fra alle retninger av kjernen. Som et resultat vil en s-karakter hybrid orbital være nærmere kjernen og dermed mer elektronegativ. Som et resultat er det sp-hybridiserte karbonet det mest elektronegative.
Spørsmål 2: Hva er hybridorbitaler?
Svar:
Hybride orbitaler dannes ved å kombinere standard atomorbitaler og resulterer i dannelsen av nye atomorbitaler.
Spørsmål 3: Hva er de fem formene for hybridisering?
Svar:
Lineær, trigonal plan, tetraedrisk, trigonal bipyramidal og oktaedrisk er de fem grunnleggende formene for hybridisering.
Spørsmål 4: Hvorfor ser amidmolekylet ut som sp 3 hybridisert, men er sp 2 ?
Svar:
Hvis atomet enten er omsluttet av to eller flere p-orbitaler eller har et ensomt par som er i stand til å hoppe inn i en p-orbital, vil den generelle hybridiseringsprosessen endres. Som et resultat, når det gjelder et amidmolekyl, går det ensomme paret inn i en p-orbital, noe som resulterer i tre tilstøtende parallelle p-orbitaler.
Spørsmål 5: Hva er Bents regel?
Svar:
Et sentralt atom koblet til en rekke grupper i et molekyl vil hybridisere, noe som fører til at orbitaler med mer s-karakter blir rettet mot elektropositive grupper og orbitaler med mer p-karakter blir rettet mot elektronegative grupper.