Hybridisierung von NO2
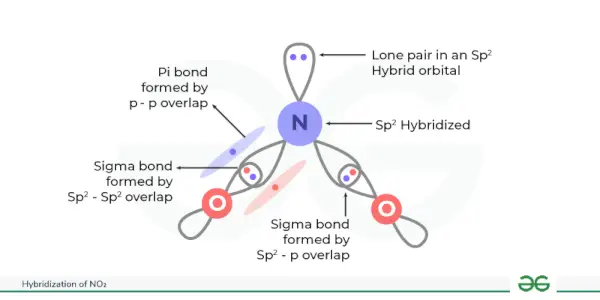
Hybridisierung von NO 2 ist sp 2 . Bei der Hybridisierung von NO entstehen drei äquivalente Hybridorbitale 2 . Stickstoffdioxid oder NO 2 besteht aus zwei Sauerstoffatomen kombiniert mit einem Stickstoffatom. Hybridisierung von NO 2 ist nützlich, um die Anordnung von Atomorbitalen und ihre Auswirkung auf ihre molekulare Struktur und Eigenschaften zu untersuchen.
In diesem Artikel werden wir die Idee der Hybridisierung untersuchen und eine klare und verständliche Erklärung der Hybridisierung von NO liefern 2 zusammen mit der Hybridisierung seiner beiden Ionen NO 2 + und nein 2 – .
Inhaltsverzeichnis
- Stickstoffdioxid[NO2]
- Was ist Hybridisierung von Stickstoffdioxid (NO2)?
- Hybridisierung von NO2+ und NO2-
- Hybridisierung von NO2: FAQs
Was ist Hybridisierung?
Unter Hybridisierung versteht man in der Chemie den Prozess der Kombination von Atomorbitalen, um neue Hybridorbitale zu erzeugen, die die Molekülgeometrie und Bindungseigenschaften einer Verbindung beeinflussen.
Verschiedene Arten der Hybridisierung sind:
- sp Hybridisierung
- sp 2 Hybridisierung
- sp 3 Hybridisierung
Mehr lesen, Hybridisierung .
Was ist Hybridisierung von Stickstoffdioxid (NO 2 )?
Hybridisierung von NO 2 ist sp 2 .
Bei dieser Hybridisierung entstehen drei äquivalente Hybridorbitale. Dabei ist Stickstoff das Zentralatom, an das zwei Sauerstoffatome gebunden sind. Stickstoff hat 5 Valenzelektronen, die in Zweiergruppen angeordnet sind 2 14 Uhr. Nun waren das eine Elektron des 2s-Orbitals und zwei Elektronen im 2p-Orbital an der Hybridisierung von NO beteiligt 2 somit werden insgesamt drei Hybridorbitale gebildet (1 + 2 = 3), was sp ergibt 2 Hybridisierung von NO 2 .
Sigma-Bindungen entstehen, wenn diese Hybridorbitale mit den Sauerstofforbitalen überlappen und das p-Orbital des Stickstoffatoms eine Pi-Bindung mit dem Sauerstoffatom bildet.

Stickstoffdioxid[NO 2 ]
Stickstoffdioxid entsteht, wenn zwei Sauerstoffatome und ein Stickstoffatom kombiniert werden und das zweiatomige Molekül NO bilden 2 . Es handelt sich um ein rötlich-braunes Gas mit markantem Aussehen und einem scharfen, beißenden Geruch. Bei Raumtemperatur ist es ein Gas, das eine gebogene oder V-förmige Molekülgeometrie aufweist.
Darüber hinaus NEIN 2 ist ein wichtiges Forschungsthema im chemischen und ökologischen Kontext, da es die Luftverschmutzung und die Chemie der Atmosphäre beeinflusst.
Eigenschaften von NO 2
Die wichtigen Eigenschaften von NO 2 Sind unten aufgeführt:
| Eigentum | Beschreibung |
|---|---|
| Chemische Formel | NEIN 2 |
| Molekulare Struktur | Gebogen oder V-förmig |
| Zustand bei Raumtemperatur | Gas |
| Farbe | Rötlich-braun |
| Geruch | Scharf, beißend |
| Schmelzpunkt | −11,2 °C |
| Siedepunkt | 21,2 °C |
Lewis-Struktur von NO 2
Die detaillierte Beschreibung der Lewis-Struktur von NO 2 Molekül ist unten angegeben:
- Stickstoff bildet eine Doppelbindung mit einem Sauerstoff und fünf Valenzelektronen und teilt sich zwei Elektronen zwischen den beiden Elementen.
- Ein Elektron wird vom zweiten Sauerstoff beigesteuert, da dieser eine Einfachbindung bildet.
- Ein freies Elektronenpaar wird vom Stickstoffatom zurückgehalten.
- Mit Stickstoff als Zentralatom und einer negativen Ladung (NO 2 – ) auf das gesamte Molekül führt diese Konfiguration zu einer linearen Struktur.

Mehr lesen,
- Stickstoffdioxid
- Stickoxide
Bindungswinkel und Geometrie bei der Hybridisierung von NO 2
Die Molekülgeometrie von NO 2 wird durch die Hybridisierung gebogen oder V-förmig. Das Stickstoffatom erfährt sp 2 Hybridisierung, die zu dieser Konfiguration führt. Die Stickstoff- und Sauerstoffatome bilden einen Bindungswinkel, der ungefähr beträgt 134 Grad . Die Anordnung der Hybridorbitale führt zu diesem verzerrten Bindungswinkel, der zu Stickstoffdioxid (NO) führt 2 ) unterschiedliche Struktur und Eigenschaften.
Hybridisierung von NO 2 + und nein 2 –
Die Hybridisierung von ist NEIN 2 + und nein 2 – nachfolgend diskutiert:
Hybridisierung von Stickstoffionen[NO 2 + ]
Die Hybridisierung von NO 2 + ist wie folgt:
- Im Stickstoffion (NO) liegt eine positive Ladung vor 2 + ).
- In NEIN 2 + sind zwei Sauerstoffatome und ein Stickstoffatom miteinander verbunden.
- Um zwei sp-Hybridorbitale zu erzeugen, durchläuft das Stickstoffatom eine sp-Hybridisierung.
- Um zwei Sigma-Bindungen zu bilden, überlappen diese sp-Hybridorbitale mit den p-Orbitalen des Sauerstoffs.
- Die Geometrie des Moleküls ist linear.
- Das Folgende ist eine Darstellung der Hybridisierung: N(sp) + O(p) + O(p).
Hybridisierung von Ionennitrat [NO 2 – ]
Die Hybridisierung von NO 2 – ist wie folgt:
- In Nitritionen (NO) liegt eine negative Ladung vor 2 – ).
- In NEIN 2 – sind zwei Sauerstoffatome und ein Stickstoffatom miteinander verbunden.
- Um drei sp zu erstellen 2 Hybridorbitale, das Stickstoffatom durchläuft sp 2 Hybridisierung.
- Um drei Sigma-Bindungen zu bilden, müssen diese sp 2 Hybridorbitale überlappen mit den p-Orbitalen von Sauerstoff.
- Die Geometrie des Moleküls ist trigonal-planar.
- Das Folgende stellt die Hybridisierung dar: N(sp 2 ) + O(p) + O(p).
Abschluss
Abschließend erfahren Sie mehr über NO 2 Die Hybridisierung bietet wichtige neue Perspektiven auf den Aufbau und die Eigenschaften des Moleküls. Die Gesamtgeometrie wird durch Stickstoff sp beeinflusst 2 Hybridisierung, die ein gebogenes oder V-förmiges Molekül mit einem Bindungswinkel von etwa 134 Grad ergibt. Die einzigartigen Eigenschaften von NO 2 werden teilweise auf die ungleichen Bindungslängen in den N-O-Bindungen zurückgeführt.
| Aspekt | Beschreibung |
|---|---|
| Hybridisierung | NEIN 2 erfährt sp 2 Hybridisierung |
| Molekulargeometrie | Gebogen oder V-förmig |
| Bindungswinkel | Ungefähr 134 Grad zwischen Stickstoff und Sauerstoff |
| Verzerrung der Bindungslänge | Ungleiche Bindungslängen aufgrund von sp 2 Hybridisierung |
Überprüfen Sie auch, Hybridisierung von SF 4
Hybridisierung von NO 2 : FAQs
1. Wie funktioniert NO 2 Auswirkungen auf die Umwelt?
Einer der Hauptluftschadstoffe ist NO 2 , was sich sowohl auf das Ökosystem als auch auf die menschliche Gesundheit auswirkt, indem es Atemwegserkrankungen und sauren Regen verursacht.
2. Welcher Bindungswinkel ist bei NO größer? 2 + oder Nein 2 ?
Während NEIN 2 hat einen kleineren Bindungswinkel bei sp2-Hybridisierung und einer trigonal-planaren Struktur, NO2+ hat einen größeren Bindungswinkel beim Durchlaufen der sp2-Hybridisierung mit einer linearen Geometrie.
3. Was ist die Geometrie von NO? 2 ?
Die Struktur des NO 2 Das Molekül ist gebogen oder V-förmig.
4. Was ist die Molekülgeometrie von NO? 2 + ?
Die Geometrie von NO 2 + Moleküle ist linear.
5. Wie viele Sigma- und Pi-Bindungen gibt es in NO₂?
NO₂ hat eine Sigma-Bindung und eine Pi-Bindung.
6. Ist NO₂ polar oder unpolar?
NO₂ ist ein polares Teilchen aufgrund des Vorhandenseins eines einzelnen Paares auf Stickstoff und der gebogenen subatomaren Berechnung, die zu einer einseitigen Ladungszirkulation führt.
7. Wie groß ist der Bindungswinkel in NO₂?
Der Bindungswinkel in NO 2 beträgt etwa 134 Grad.