Hybridisering

Konceptet med hybridisering er defineret som processen med at kombinere to atomare orbitaler for at skabe en ny type hybridiserede orbitaler. Denne sammenblanding resulterer typisk i dannelsen af hybridorbitaler med helt forskellige energier, former og så videre. Hybridisering udføres primært af atomare orbitaler med samme energiniveau. Imidlertid kan både fuldt fyldte og halvfyldte orbitaler deltage i denne proces, hvis deres energier er lige store. Begrebet hybridisering er en udvidelse af valensbindingsteori, der hjælper os med at forstå bindingsdannelse, bindingsenergier og bindingslængder.
Hvad er hybridisering?
Når to atomare orbitaler kombineres for at danne en hybrid orbitaler i et molekyle, omfordeles energien af orbitaler af individuelle atomer for at give orbitaler med ækvivalent energi. Dette er kendt som hybridisering.
Atomorbitaler af sammenlignelige energier blandes sammen under hybridiseringsprocessen, som for det meste involverer sammensmeltning af to orbitaler eller to 'p' orbitaler eller blanding af en 's' orbital med en 'p' orbital såvel som en 's' orbital med en 'd' orbital.
Hybride orbitaler er de nye orbitaler dannet som et resultat af denne proces. Endnu vigtigere kan hybridorbitaler bruges til at forklare atombindingsegenskaber og molekylær geometri. Kulstof danner for eksempel fire enkeltbindinger, hvor valensskallens orbitaler kombineres med tre valensskal p-orbitaler. Denne kombination genererer fire ækvivalente sp 3 blandinger. Disse vil blive arrangeret i et tetraedrisk mønster omkring kulstoffet, som er bundet til fire forskellige atomer.
Trin til at bestemme typen af hybridisering
For at forstå typen af hybridisering i et atom eller en ion, skal følgende regler følges.
- Bestem først det samlede antal valenselektroner indeholdt i et atom eller ion.
- Tæl derefter antallet af ensomme par knyttet til det pågældende atom eller ion.
- Nu kan antallet af nødvendige orbitaler beregnes ved at tilføje antallet af dupleks eller oktet og antallet af ensomme elektronpar.
- Det skal bemærkes, at geometrien af orbitaler i atomer eller ioner er anderledes, når der ikke er et enkelt elektronpar.
Funktioner ved hybridisering
- Hybridisering sker mellem atomare orbitaler med samme energier.
- Antallet af dannede hybridorbitaler er lig med antallet af atomare orbitaler, der blandes.
- Det er ikke nødvendigt for alle halvfyldte orbitaler at deltage i hybridisering. Selv orbitaler, der er helt fyldte, men har lidt varierende energi, kan deltage.
- Hybridisering sker kun under bindingsdannelse, ikke i et enkelt gasformigt atom.
- Hvis hybridiseringen af molekylet er kendt, kan molekylets form forudsiges.
- Den større lap af hybridorbitalen er altid positiv, mens den mindre lap på den modsatte side altid er negativ.
Typer af hybridisering
Hybridisering kan klassificeres som sp 3 , sp 2 , sp., sp 3 d, sp 3 d 2 eller sp 3 d 3 baseret på de typer orbitaler, der er involveret i blanding.
sp Hybridisering
Det opstår, når en s og en p orbital i et atoms hovedskal kombineres for at danne to nye ækvivalente orbitaler. De nydannede orbitaler er kendt som sp-hybridiserede orbitaler. Det producerer lineære molekyler i en 180° vinkel. Det indebærer at kombinere ens orbital og en 'p' orbital af samme energi for at producere en ny hybrid orbital kendt som en sp hybridiseret orbital.
- Det er også kendt som diagonal hybridisering.
- Hver sp-hybridiseret orbital indeholder den samme mængde s- og p-tegn.
- Alle berylliumforbindelser, såsom BeF 2 , Godt 2 og BeCl 2 , er eksempler.

sp 2 Hybridisering
Det opstår, når en s og to p-orbitaler af det samme atoms skal kombineres for at danne tre ækvivalente orbitaler. De nydannede orbitaler er kendt som sp 2 hybride orbitaler. Det er også kendt som trigonal hybridisering. Det indebærer at kombinere ens orbital med to 'p' orbitaler af samme energi for at skabe en ny hybrid orbital kendt som sp 2 . En trigonal symmetriblanding af s- og p-orbitaler holdes ved 120 grader. Alle tre hybridorbitaler forbliver i samme plan og danner en 120° vinkel med hinanden.
- Hvert dannet hybridorbital har en 33,33 % og en 66,66 % 'p' karakter.
- Molekylerne med en trekantet plan form har et centralt atom, der er knyttet til tre andre atomer og er sp. 2 hybridiseret. Borforbindelser er eksempler.
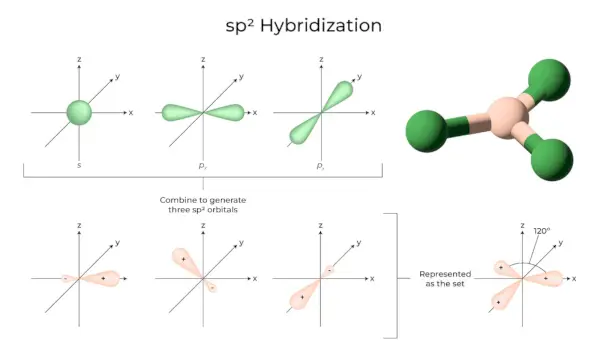
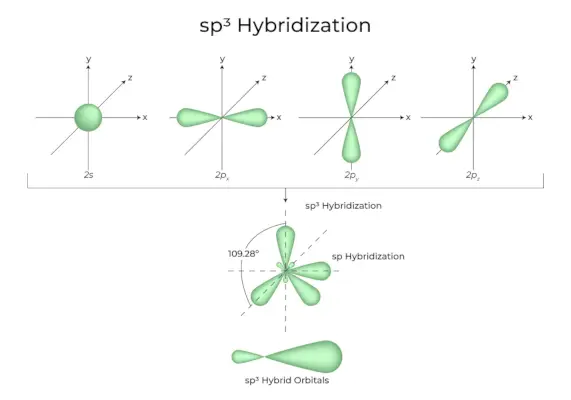
sp 3 Hybridisering
Når en 's' orbitaler og tre 'p' orbitaler fra den samme skal af et atom kombineres for at danne fire nye ækvivalente orbitaler, er hybridiseringen kendt som tetraedrisk hybridisering eller sp 3 . De nydannede orbitaler er kendt som sp 3 hybride orbitaler. Disse peger på de fire hjørner af et regulært tetraeder og danner en 109°28′ vinkel med hinanden.
- Sp 3 hybridorbitaler danner en 109,28 graders vinkel.
- Hver hybrid orbital har en 25% s karakter og en 75% p karakter.
- Ethan og metan er to eksempler.
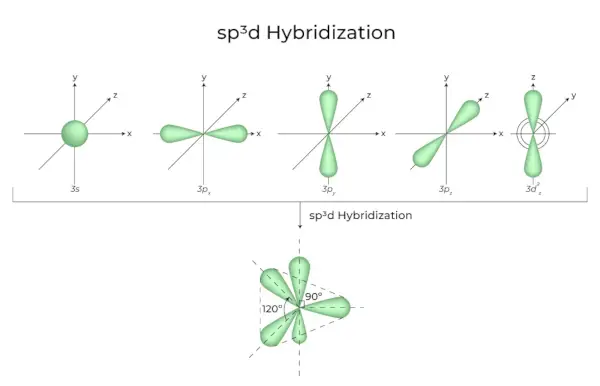
sp 3 d Hybridisering
Blandingen af 1s orbitaler, 3p orbitaler og 1d orbitaler resulterer i 5 sp3d hybridiserede orbitaler med samme energi. Deres geometri er trigonal bipyramidal. Kombinationen af s, p og d orbitaler resulterer i trigonal bipyramidal symmetri. De ækvatoriale orbitaler er tre hybridorbitaler, der er orienteret i en 120° vinkel i forhold til hinanden og ligger i det vandrette plan.
- De resterende to orbitaler, kendt som aksiale orbitaler, er i det lodrette plan i 90 graders plan af de ækvatoriale orbitaler.
- Hybridisering i phosphorpentachlorid, for eksempel (PCl 5 ).
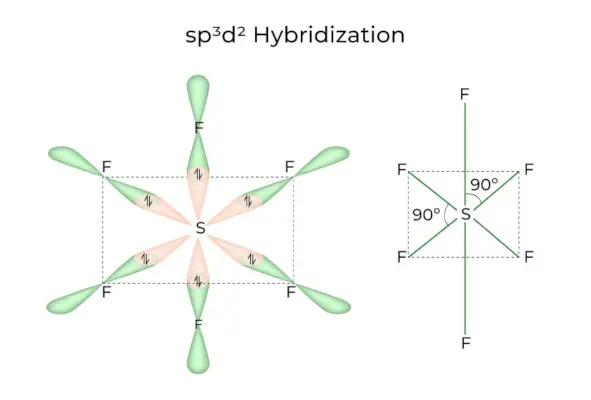
sp 3 d 2 Hybridisering
Når 1s, 3p og 2d orbitaler kombineres for at danne 6 identiske sp 3 d 2 hybridorbitaler, kaldes hybridiseringen sp 3 d 2 Hybridisering. Disse syv orbitaler peger på hjørnerne af et oktaeder. De hælder i en 90-graders vinkel i forhold til hinanden.
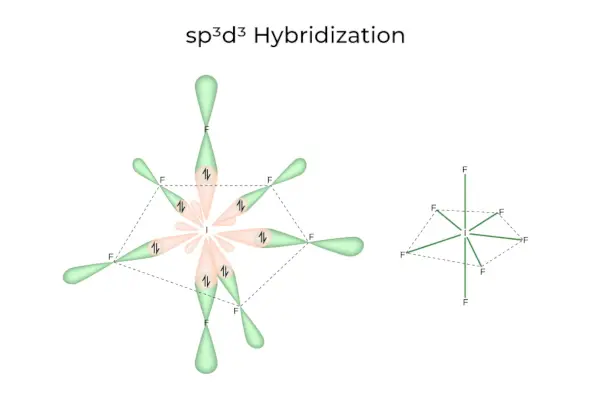
sp 3 d 3 Hybridisering
Den har 1s, 3p og 3d orbitaler, som tilsammen danner 7 identiske sp 3 d 3 hybride orbitaler. Disse syv orbitaler peger på hjørnerne af en femkantet bipyramidal. f.eks. HVIS 6 .
Hybridiseringsformer
- Lineær: sp-hybridiseringen er forårsaget af interaktionen af to-elektrongrupper; omløbsvinklen er 180°. Trigonal plan: Tre elektrongrupper er involveret, hvilket resulterer i sp 2 hybridisering; orbitalerne er 120° fra hinanden. Tetraedrisk: Fire elektrongrupper er involveret, hvilket resulterer i sp 3 hybridisering; banevinklen er 109,5°. Trigonal bipyramidal: Fem elektrongrupper er involveret, hvilket resulterer i sp 3 d hybridisering; banevinklerne er 90° og 120°. Octahedral: Seks elektrongrupper er involveret, hvilket resulterer i sp 3 d 2 hybridisering; orbitalerne er 90° fra hinanden.
Ofte stillede spørgsmål på Hybridisering
Spørgsmål 1: Blandt sp, sp2 og sp3, hvilken hybrid orbital er mere elektronegativ?
Svar:
Procentdelen af s karakter i sp, sp 2 og sp 3 hybridiseret kulstof er henholdsvis 50 %, 33,33 % og 25 %. På grund af den sfæriske form af s-kredsløbet tiltrækkes den jævnt fra alle retninger af kernen. Som følge heraf vil en s-karakter hybrid orbital være tættere på kernen og dermed mere elektronegativ. Som et resultat er det sp-hybridiserede kulstof det mest elektronegative.
Spørgsmål 2: Hvad er hybridorbitaler?
Svar:
Hybride orbitaler dannes ved at kombinere standard atomorbitaler og resulterer i dannelsen af nye atomare orbitaler.
Spørgsmål 3: Hvad er de fem former for hybridisering?
Svar:
Lineær, trigonal plan, tetraedrisk, trigonal bipyramidal og oktaedral er de fem grundlæggende former for hybridisering.
Spørgsmål 4: Hvorfor ligner amidmolekylet sp 3 hybridiseret, men er sp 2 ?
Svar:
Hvis atomet enten er omsluttet af to eller flere p-orbitaler eller har et ensomt par, der er i stand til at springe ind i en p-orbital, vil den generelle hybridiseringsproces ændre sig. Som et resultat, i tilfælde af et amidmolekyle, går det enlige par ind i en p-orbital, hvilket resulterer i tre tilstødende parallelle p-orbitaler.
Spørgsmål 5: Hvad er Bents regel?
Svar:
Et centralt atom forbundet med adskillige grupper i et molekyle vil hybridisere, hvilket får orbitaler med mere s-karakter til at blive rettet mod elektropositive grupper og orbitaler med mere p-karakter til at blive rettet mod elektronegative grupper.