Hybridizace NO2
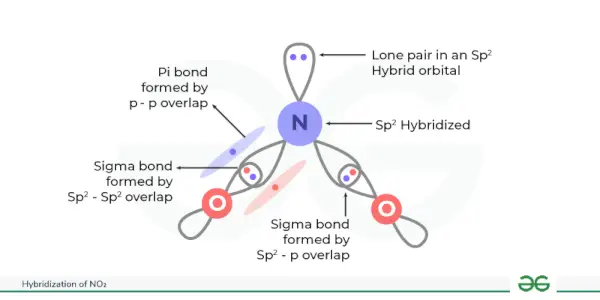
Hybridizace NO 2 je sp 2 . Hybridizací NO jsou vytvořeny tři ekvivalentní hybridní orbitaly 2 . Oxid dusičitý neboli NO 2 sestává ze dvou atomů kyslíku spojených s jedním atomem dusíku. Hybridizace NO 2 je užitečné zkoumat uspořádání atomových orbitalů a jeho vliv na jeho molekulární strukturu a vlastnosti.
V tomto článku prozkoumáme myšlenku hybridizace a poskytneme jasné a srozumitelné vysvětlení hybridizace NO 2 spolu s hybridizací obou jejích iontů NO 2 + a žádná 2 – .
Obsah
- Oxid dusičitý [NO2]
- Co je hybridizace oxidu dusnatého (NO2)?
- Hybridizace NO2+ a NO2-
- Hybridizace NO2: FAQ
Co je hybridizace?
Hybridizace je v chemii proces kombinování atomových orbitalů za účelem vytvoření nových hybridních orbitalů, které ovlivňují molekulární geometrii a vazebné charakteristiky sloučeniny.
Různé typy hybridizace jsou:
- sp Hybridizace
- sp 2 Hybridizace
- sp 3 Hybridizace
Přečtěte si více, Hybridizace .
Co je hybridizace oxidu dusnatého (NO 2 )?
Hybridizace NO 2 je sp 2 .
Při této hybridizaci se vytvoří tři ekvivalentní hybridní orbitaly. Zde je dusík centrální atom vázaný se dvěma atomy kyslíku. Dusík má 5 valenčních elektronů uspořádaných po 2s 2 2p. Nyní se jeden elektron orbitalu 2s a dva elektrony orbitalu 2p podílely na hybridizaci NO 2 tak se vytvoří celkem tři hybridní orbitaly (1 + 2 = 3), což dává sp 2 hybridizace NO 2 .
Sigma vazby jsou vytvořeny, když se tyto hybridní orbitaly překrývají s kyslíkovými orbitaly a p orbital atomu dusíku tvoří pí vazbu s atomem kyslíku.

Oxid dusičitý[NO 2 ]
Oxid dusičitý vzniká, když se spojí dva atomy kyslíku a jeden atom dusíku a vytvoří dvouatomovou molekulu NO 2 . Je to červenohnědý plyn, který má výrazný vzhled a ostrý, kousavý zápach. Při pokojové teplotě je to plyn, který vykazuje ohnutou nebo molekulární geometrii ve tvaru V.
Dále NE 2 je důležitým tématem výzkumu v chemických a environmentálních souvislostech, protože ovlivňuje znečištění ovzduší a chemii atmosféry.
Vlastnosti NO 2
Důležité vlastnosti NO 2 jsou uvedeny níže:
| Vlastnictví | Popis |
|---|---|
| Chemický vzorec | NE 2 |
| Molekulární struktura | Ohnuté nebo ve tvaru V |
| Stav při pokojové teplotě | Plyn |
| Barva | Červenohnědá |
| Zápach | Ostré, kousavé |
| Bod tání | -11,2 °C |
| Bod varu | 21,2 °C |
Lewisova struktura NO 2
Podrobný popis Lewisovy struktury NO 2 molekula je uvedena níže:
- Dusík tvoří dvojnou vazbu s jedním kyslíkem a pěti valenčními elektrony, přičemž mezi těmito dvěma prvky sdílí dva elektrony.
- Jedním elektronem přispívá druhý kyslík, protože tvoří jednoduchou vazbu.
- Jeden osamocený pár je zadržen atomem dusíku.
- S dusíkem jako centrálním atomem a záporným nábojem (NO 2 – ) na celé molekule má tato konfigurace za následek lineární strukturu.

Přečtěte si více,
- Oxid dusičitý
- Oxidy dusíku
Úhel vazby a geometrie v hybridizaci NO 2
Molekulární geometrie NO 2 v důsledku hybridizace se ohýbá nebo má tvar V. Atom dusíku podléhá sp 2 hybridizace, která má za následek tuto konfiguraci. Atomy dusíku a kyslíku tvoří vazebný úhel, který je zhruba 134 stupňů . Uspořádání hybridních orbitalů má za následek tento deformovaný vazebný úhel, který se přidává k oxidu dusičitému (NO 2 ) odlišná struktura a vlastnosti.
Hybridizace NO 2 + a žádná 2 –
Hybridizace je NO 2 + a žádná 2 – diskutováno níže:
Hybridizace dusíkového iontu [NO 2 + ]
Hybridizace NO 2 + je následující:
- V dusíkovém iontu je přítomen kladný náboj (NO 2 + ).
- V NO 2 + jsou spolu vázány dva atomy kyslíku a jeden atom dusíku.
- Pro vytvoření dvou sp hybridních orbitalů prochází atom dusíku sp hybridizací.
- Aby se vytvořily dvě sigma vazby, tyto sp hybridní orbitaly se překrývají s p orbitaly kyslíku.
- Geometrie molekuly je lineární.
- Následuje znázornění hybridizace: N(sp) + O(p) + O(p).
Hybridizace iontového dusičnanu [NO 2 – ]
Hybridizace NO 2 – je následující:
- Záporný náboj je přítomen v dusitanových iontech (NO 2 – ).
- V NO 2 – jsou spolu vázány dva atomy kyslíku a jeden atom dusíku.
- K vytvoření tří sp 2 hybridní orbitaly, atom dusíku prochází sp 2 hybridizace.
- K vytvoření tří sigma vazeb, tyto sp 2 hybridní orbitaly se překrývají s p orbitaly kyslíku.
- Geometrie molekuly je trigonální rovina.
- Následující představuje hybridizaci: N(sp 2 ) + O(p) + O(p).
Závěr
Na závěr, dozvědět se více o NO 2 Hybridizace nabízí důležité nové pohledy na složení a vlastnosti molekuly. Celková geometrie je ovlivněna dusíkem sp 2 hybridizace, která poskytuje ohnutou molekulu nebo molekulu ve tvaru V s vazebným úhlem asi 134 stupňů. Jedinečné vlastnosti NO 2 jsou částečně připisovány nestejným délkám vazeb v N-O vazbách.
| Aspekt | Popis |
|---|---|
| Hybridizace | NE 2 podstoupí sp 2 hybridizace |
| Molekulární geometrie | Ohnuté nebo ve tvaru V |
| Bondův úhel | Přibližně 134 stupňů mezi dusíkem a kyslíkem |
| Zkreslení délky vazby | Nestejné délky vazby v důsledku sp 2 hybridizace |
Zkontrolujte také, Hybridizace SF 4
Hybridizace NO 2 : Nejčastější dotazy
1. Jak se NE 2 Ovlivnit životní prostředí?
Jednou z hlavních látek znečišťujících ovzduší je NO 2 , který ovlivňuje jak ekosystém, tak lidské zdraví tím, že způsobuje dýchací potíže a kyselé deště.
2. Který Bond Angle je větší mezi NO 2 + nebo ne 2 ?
Zatímco NE 2 má menší vazebný úhel s hybridizací sp2 a trigonální rovinnou strukturou, NO2+ má širší vazebný úhel, protože prochází hybridizací sp s lineární geometrií.
3. Co je geometrie NO 2 ?
Struktura NO 2 molekula je ohnutá nebo ve tvaru V.
4. Co je molekulární geometrie NO 2 + ?
Geometrie NO 2 + molekuly jsou lineární.
5. Jaký počet vazeb Sigma a pí je v NO₂?
NO₂ má jednu sigma vazbu a jednu pí vazbu.
6. Je NO₂ polární nebo nepolární?
NO₂ je polární částice kvůli přítomnosti osamoceného páru na dusíku a prohnutému subatomárnímu výpočtu, který vyvolává nerovnoměrnou cirkulaci náboje.
7. Jaký je úhel vazby v NO₂?
Vazebný úhel v NO 2 je asi 134 stupňů.